Tabla Periódica: qué es y todas sus características
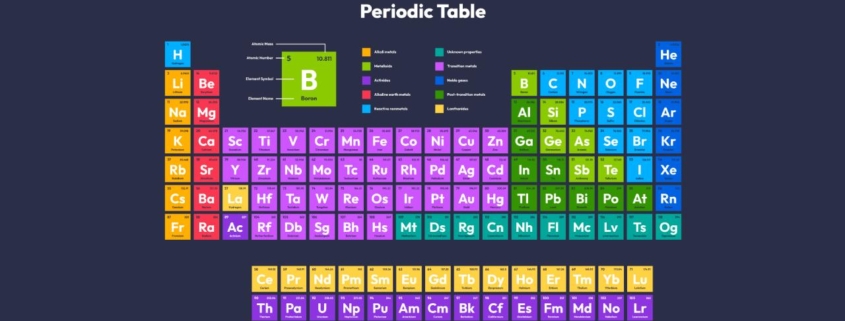
La tabla periódica de los elementos es una herramienta esencial en el mundo de la química. Es una representación visual que organiza todos los elementos químicos conocidos en función de sus propiedades y relaciones. A través de esta tabla, los científicos y estudiantes pueden entender mejor cómo interactúan los elementos y predecir cómo se comportarán en diferentes situaciones. Esta organización sistemática ha sido fundamental para el avance de la química y ha permitido descubrimientos y aplicaciones que han transformado nuestra vida cotidiana.
Tabla de contenidos
¿Qué es la Tabla Periódica?
La tabla periódica es una disposición de todos los elementos químicos, organizados en función de su número atómico, configuración electrónica y propiedades químicas recurrentes. Los elementos se presentan en orden creciente de número atómico, que es el número de protones en el núcleo de un átomo. Esta disposición permite que elementos con propiedades similares queden agrupados juntos. Además, la tabla periódica ofrece una ventana a la estructura fundamental de la materia.
La tabla periódica tambien es una herramienta predictiva. Al observar la disposición de los elementos, los químicos pueden prever cómo se comportará un elemento en una reacción, qué tipo de enlaces formará y con qué otros elementos se combinará preferentemente. Esta capacidad predictiva no es solo una coincidencia feliz; es el resultado de la estructura subyacente de los átomos y cómo los electrones, esas diminutas partículas cargadas, se organizan alrededor del núcleo.
Origen de la Tabla Periódica
En 1869, el mundo científico fue testigo de un avance monumental cuando el químico ruso Dmitri Mendeléyev presentó la primera versión de la Tabla Periódica. Esta versión inicial contenía 63 elementos, una fracción de los 118 que conocemos hoy, y estaba meticulosamente organizada según sus propiedades químicas. Sin embargo, Mendeléyev no fue el único en este empeño. En una coincidencia de genialidad, el químico alemán Julius Lothar Meyer también publicó su versión de la tabla, pero con un enfoque en las propiedades físicas de los átomos. Lo que ambos tenían en común era su visión futurista: organizaron los elementos en filas y dejaron espacios estratégicos para aquellos elementos que intuían aún estaban por ser descubiertos.
Mendeléyev no se detuvo ahí. En 1871, presentó una versión revisada de su tabla, esta vez organizando los elementos en columnas, desde la I hasta la VIII, basándose en sus estados de oxidación. Esta organización reflejaba las propiedades comunes de los elementos y sentó las bases para la comprensión moderna de la química. Sin embargo, la evolución de la tabla no concluyó con Mendeléyev. En 1923, el químico americano Horace Groves Deming introdujo una tabla periódica con 18 columnas claramente identificadas, estableciendo el diseño que se ha convertido en el estándar y que continúa siendo utilizado en la actualidad.
Elementos de la Tabla Periódica
Cada elemento de la tabla periódica está representado por un conjunto de información que nos da una visión detallada de su identidad y características. Esta información incluye el símbolo químico, el número atómico y la masa atómica.
Símbolo químico
Es una abreviatura, generalmente de una o dos letras, que representa el nombre del elemento. Por ejemplo, «H» para hidrógeno, «O» para oxígeno y «Au» para oro. Este símbolo se encuentra en el centro de la celda del elemento en la tabla periódica.
Número atómico
Es un número entero que indica la cantidad de protones en el núcleo del átomo de un elemento. Es un identificador único para cada elemento y determina la posición del elemento en la tabla periódica. El número atómico se encuentra generalmente en la parte superior de la celda del elemento, justo encima del símbolo químico.
Masa atómica
Representa la masa promedio de los átomos de un elemento, teniendo en cuenta todos sus isótopos naturales. Se mide en unidades de masa atómica (uma) y es una aproximación de la suma total de protones y neutrones en el núcleo de un átomo. La masa atómica se encuentra generalmente en la parte inferior de la celda del elemento, justo debajo del símbolo químico.
A fecha de hoy, hay 118 elementos confirmados en la tabla periódica, desde el hidrógeno (H) con número atómico 1, hasta el oganesón (Og) con número atómico 118. Cada uno de estos elementos tiene sus propias propiedades y aplicaciones, y juntos forman el vasto y diverso mundo de la química.
Valencias tabla periodica
La valencia es una medida de la capacidad de un elemento para combinarse con otros elementos. Se refiere al número de electrones que un átomo puede ganar, perder o compartir al formar un compuesto. En la tabla periódica de los elementos, la valencia de un elemento puede predecirse a partir de su posición. Por ejemplo, los metales alcalinos en el grupo 1 tienen una valencia de +1, mientras que los halógenos en el grupo 17 tienen una valencia de -1. Es esencial conocer las valencias para entender cómo se forman los compuestos químicos.
Grupos y períodos de la Tabla Periódica
La tabla periódica está organizada en filas y columnas llamadas períodos y grupos, respectivamente. Esta disposición no es arbitraria, como hemos comentado con anterioridad, sino que refleja la estructura subyacente de los átomos y cómo los electrones están dispuestos en diferentes capas alrededor del núcleo.
Períodos
Los períodos son las filas horizontales de la tabla periódica. Hay 7 períodos en total, y cada uno corresponde a un nivel de energía principal en el que los electrones pueden orbitar alrededor del núcleo.
- Primer período: Contiene solo 2 elementos, hidrógeno y helio. Es el nivel de energía más bajo y tiene la menor capacidad para electrones.
- Segundo y tercer período: Cada uno con 8 elementos, desde el litio (Li) hasta el neón (Ne) y del sodio (Na) hasta el argón (Ar), respectivamente. Estos períodos llenan los orbitales s y p.
- Cuarto y quinto período: Más extensos, con 18 elementos cada uno, introducen los orbitales d.
- Sexto período: Con 32 elementos, introduce los orbitales f, dando lugar a los lantánidos.
- Séptimo período: Aún en expansión con el descubrimiento de nuevos elementos, contiene los actínidos y otros elementos superpesados.
Grupos
Los grupos son las columnas verticales y hay 18 en total. Los elementos en un grupo tienen propiedades químicas similares debido a que tienen la misma configuración electrónica en su capa externa.
- Grupo 1 – Metales alcalinos: Incluye elementos como el litio, sodio y potasio. Son altamente reactivos.
- Grupo 2 – Metales alcalinotérreos: Como el berilio, magnesio y calcio. Menos reactivos que los alcalinos pero aún así reactivos.
- Grupos 3-12 – Metales de transición: Incluyen elementos como el hierro, cobre y zinc. Son menos reactivos y a menudo se encuentran en la naturaleza en su forma elemental.
- Grupo 13: A menudo llamado grupo del boro.
- Grupo 14: Grupo del carbono, incluye elementos como el carbono y el silicio.
- Grupo 15: Grupo del nitrógeno o pnictógenos.
- Grupo 16: Calcógenos, incluyendo el oxígeno, azufre y selenio.
- Grupo 17 – Halógenos: Son muy reactivos y comprenden el flúor, cloro, bromo, entre otros.
- Grupo 18 – Gases nobles: Son gases inertes y no reactivos, como el helio, neón y argón.
Propiedades de los elementos
Las propiedades de los elementos en la tabla periódica varían de manera predecible a medida que uno se mueve a través de la tabla. Estas propiedades incluyen la electronegatividad, el radio atómico, la energía de ionización y la afinidad electrónica. Por ejemplo, la electronegatividad aumenta de izquierda a derecha a través de un período y disminuye al descender por un grupo. Estas tendencias en las propiedades son el resultado de la estructura electrónica de los átomos y son fundamentales para predecir y entender el comportamiento químico de los elementos.
Elementos metales
Los metales de la tabla periodica son elementos que, en general, son buenos conductores de calor y electricidad. Son maleables, dúctiles y tienen un brillo característico. La mayoría de los elementos de la tabla periódica son metales, y se encuentran principalmente en la parte izquierda y central de la tabla. Incluyen grupos como los metales alcalinos, metales alcalinotérreos y metales de transición. Estos metales desempeñan roles cruciales en nuestra vida cotidiana y en la industria, desde la construcción y la electrónica hasta la generación de energía y la fabricación de joyas.
Elementos no metales
Los no metales son elementos que, en general, no son buenos conductores de calor y electricidad. Tienen propiedades opuestas a las de los metales. Se encuentran principalmente en la parte superior derecha de la tabla periódica. Incluyen elementos como el hidrógeno, carbono, nitrógeno y oxígeno. Estos elementos son esenciales para la vida y desempeñan roles fundamentales en la química orgánica, la atmósfera y los procesos biológicos.
Elementos halógenos
Los halógenos son el grupo 17 de la tabla periódica e incluyen el flúor, cloro, bromo, yodo y astato. Son conocidos por su alta reactividad, especialmente con los metales alcalinos, con los que forman sales. Por ejemplo, el sodio y el cloro reaccionan para formar cloruro de sodio, comúnmente conocido como sal de mesa. Estos elementos tienen una amplia variedad de aplicaciones, desde la desinfección del agua y la producción de medicamentos hasta la fabricación de tintes y productos químicos industriales.
Gases nobles
Los gases nobles, también conocidos como gases inertes, son el grupo 18 de la tabla periódica. Incluyen el helio, neón, argón, kriptón, xenón y radón. Son conocidos por su baja reactividad debido a que tienen su última capa de electrones completa, lo que los hace estables.
Últimos elementos añadidos a la tabla periódica
Hasta fecha de 2023, los últimos elementos añadidos a la tabla periódica fueron el nihonio (Nh), moscovio (Mc), tenesino (Ts) y oganesón (Og), que fueron oficialmente reconocidos en 2016. Estos elementos superpesados se crearon en laboratorios y no se encuentran naturalmente en la Tierra. Su adición a la tabla periódica es el resultado de décadas de investigación en física y química nuclear.