¿Cuáles son las regularidades de la tabla periódica?
Fecha transmisión: 23 de Junio de 2022
Valoración de la comunidad:
Última Actualización:
2 de Agosto de 2022 a las 14:59Aprendizaje esperado: identifica la información de la tabla periódica, y analiza sus regularidades y su importancia en la organización de los elementos químicos.
Énfasis: explicar la valencia e identificar las regularidades de elementos químicos representativos como el radio atómico y la electronegatividad.
¿Qué vamos a aprender?
Lee la siguiente frase:
“Si una persona es perseverante, aunque sea dura de entendimiento, se hará inteligente; y aunque sea débil se transformará en fuerte”.
Leonardo Da Vinci.
Los materiales que utilizarás son tu cuaderno de Ciencias. Química, tu libro de texto, tabla periódica de los elementos, lápiz, colores y bolígrafo.
¿Qué hacemos?
En el mundo de los átomos existe una capacidad de combinación llamada valencia.
En química se le llama valencia a la capacidad de combinación de un átomo de determinado elemento. Según los modelos atómicos que se emplean hoy en día para explicar el comportamiento de la materia, los electrones en el átomo están acomodados en distintos niveles de energía.
A los electrones que se encuentran en el último nivel se les llama electrones de valencia, y son los responsables de los enlaces entre átomos para formar compuestos.
Como recordarás, el número atómico define el número de protones y en un átomo eléctricamente neutro es igual al número de electrones, es decir, que tienen igual número de cargas positivas y de cargas negativas.
Sin embargo, en una reacción química, al ceder o ganar electrones, pueden alterar su carga eléctrica; a los átomos con carga eléctrica se les denomina iones.
Cuando un átomo cede electrones, queda con exceso de protones, por lo que su carga eléctrica será positiva; a estos se les llama cationes.
Si un átomo acepta electrones, queda con exceso de cargas negativas y forma aniones.
Es importante saber qué elementos de la tabla periódica pueden ceder y aceptar electrones. En la fórmula química de un compuesto, como son sales binarias, primero se escribe el símbolo del elemento que cede electrones y que queda con carga positiva, y después se escribe el símbolo del elemento que acepta electrones y que queda con carga negativa.
Mendeléyev fue un científico ruso que postuló que los elementos tienen propiedades periódicas y los ordenó en la primera propuesta de la tabla periódica de los elementos.
Uno de los criterios que utilizó Mendeléyev para clasificar a los elementos, fue el tipo de compuestos que forman con el hidrógeno y el oxígeno. Por ejemplo, los elementos del grupo 1, hidrógeno, litio, sodio, potasio, rubidio, cesio y francio, a los que representarás con la letra R, forman óxidos con el oxígeno, cuyo símbolo es O, formando compuestos con fórmula R2O, la cual, significa que un átomo de oxígeno se combina con dos átomos de los elementos de ese grupo.
Si lo analizas permite obtener la valencia de los elementos involucrados.
Cabe mencionar que el subíndice 1 del oxígeno por convención, no se escribe, pero se muestra en los siguientes ejemplos para hacer explícita la valencia del elemento positivo.
Por ejemplo, toma al hidrógeno, que está en el grupo 1, recuerda que su símbolo es H. Al sustituir en la fórmula R2O, queda H2O, la fórmula del agua, también llamado óxido de hidrógeno.
Puedes encontrar con facilidad la valencia que tienen los elementos; observa, el hidrógeno tiene el subíndice 2, que corresponde a la valencia del oxígeno y éste tiene subíndice 1, que corresponde a la valencia del hidrógeno.
Es importante verificar que el compuesto debe de ser eléctricamente neutro, lo cual le da estabilidad a una sustancia.
Como en la fórmula primero se escribe el símbolo del elemento con carga positiva y después el símbolo del elemento con carga negativa, entonces los números de oxidación quedan de la siguiente manera.
Hidrógeno +1
Oxígeno -2.
Trabaja el ejemplo del siguiente elemento que es el litio, para formar el óxido de litio. Recuerda que la fórmula general es R2O, por lo tanto, sustituyes R y colocas el símbolo del litio Li, anotas el subíndice 2 y después el símbolo del oxígeno.
Por lo tanto, la fórmula es Li2O, la valencia del oxígeno se puede deducir por el subíndice del litio que es dos, asimismo, la valencia del litio se puede deducir por el subíndice del oxígeno que es 1.
Como primero se escribe el símbolo del elemento con carga positiva, el número de oxidación del litio es de +1, después se escribe el símbolo del oxígeno al tener carga negativa, su número de oxidación es de -2. Sin embargo, puede variar dependiendo de los compuestos que forme el oxígeno con otros elementos.
Ahora ya puedes obtener la fórmula y las valencias de los elementos del grupo 1. En el caso de los elementos del siguiente grupo de la tabla periódica. Si interaccionas químicamente el oxígeno con los elementos del grupo 2, la fórmula que puedes utilizar es RO, debido a que ambos tienen valencia 2 donde R puede ser berilio, magnesio, calcio, estroncio, bario o radio; el símbolo del oxígeno es O.
Ahora arma la del óxido de berilio. Considera la fórmula RO, sustituye R por el símbolo del berilio que es Be, enseguida se escribe el símbolo del oxígeno que es O, y la fórmula queda como BeO. La fórmula queda así porque, como ya se mencionó anteriormente, ambos elementos tienen valencia 2, y al ser iguales se pueden omitir los subíndices
Toma en cuenta cómo primero se escribe el símbolo del elemento con carga positiva y después el símbolo del elemento con carga negativa, el número de oxidación del berilio es +2 y el del oxígeno es de -2.
En la tabla periódica puedes encontrar muchos datos importantes. En esta ocasión te enfocarás en la valencia. Puedes encontrar este dato en la siguiente tabla.
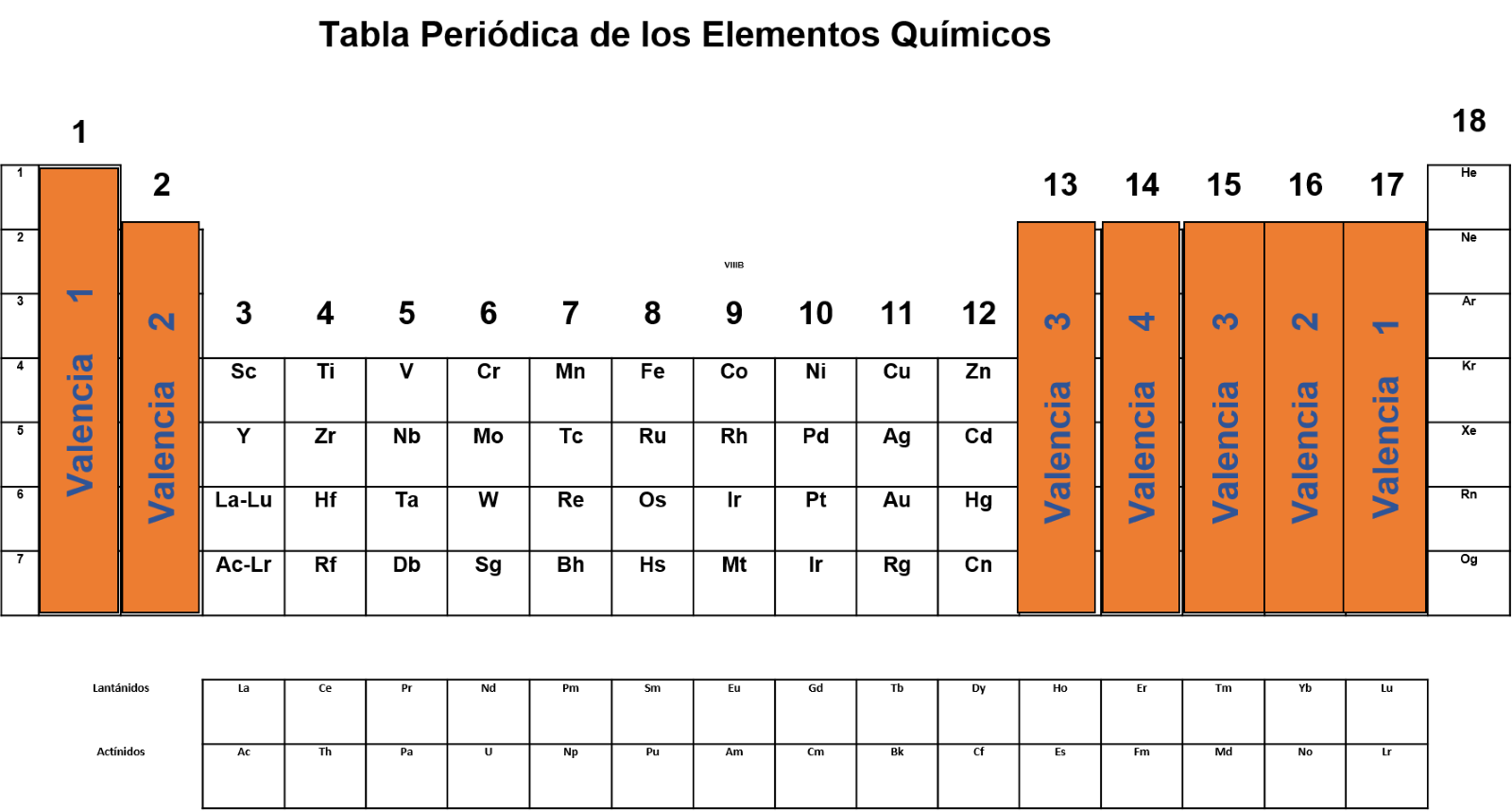
Cabe señalar que valencia y número de oxidación no son lo mismo, la carga que presenta un elemento en un compuesto químico representa su número de oxidación, el cual depende o está relacionado con la valencia. Para un halógeno le es más fácil ganar un electrón que perder 7, por lo que al formar compuestos tiene a ganar un electrón y por lo tanto a adquirir una carga 1- Es por eso que puedes considerar que la valencia, definida como la capacidad para combinarse de los halógenos, es de 1.
Cuando un metal interacciona químicamente con un halógeno se forma el halogenuro del metal, por ejemplo, el cloruro de sodio y el fluoruro de potasio, entre otros.
Diseña un juego de memorama, para lo cual necesitarás el siguiente material.
-
14 tarjetas de 10 centímetros de cada lado en cartulina color blanco
-
7 tarjetas de 10 centímetros de cada lado en cartulina color azul claro
-
Marcadores de agua del color que desees
Primero coloca en siete tarjetas blancas a los halógenos con su símbolo, nombre y valencia; así como en otras siete su par, que será un metal que contendrá el nombre, símbolo y valencia de los elementos del grupo uno. Las tarjetas de color azul tendrán la formula y nombre del compuesto.
El juego comienza cuando uno de los jugadores destapa una tarjeta azul, la cual contiene el nombre y la fórmula del compuesto, después buscará en dos tarjetas blancas a los elementos indicados en la fórmula, las levantará y las enseñará a los jugadores. Si acierta se quedará con las tarjetas y ganará un par de tarjetas blancas.
Eventualmente el segundo jugador destapara una tarjeta azul, observará la fórmula y buscara en las tarjetas blancas a los elementos indicados en la fórmula. En caso de no coincidir con los elementos de la fórmula, volverá a voltear las tarjetas y continuará el juego hasta que los jugadores hayan completado con las tarjetas blancas las fórmulas indicadas en las tarjetas de color azul.
Puedes modificar el juego con algunas variantes colocando el oxígeno para formar óxidos, con el azufre, para formar sulfuros y en la medida que te familiarices con otros cationes y aniones.
Es importante mencionar que esta fórmula para conocer las valencias de los elementos químicos sólo es aplicable para aquellas fórmulas químicas que están formadas por dos elementos, es decir, compuestos binarios.
Se considerará la estructura de Lewis para explicar la valencia. Comenzarás con mencionar que los electrones que están en la órbita o nivel de energía más alejado del núcleo, son los que pueden representarse en la estructura de Lewis, ya que son los electrones de valencia los que intervienen en la formación de un compuesto.
Recuerda que los grupos de los elementos representativos tienen el siguiente número de electrones de valencia que se encuentran en la órbita o nivel de energía más alejado del núcleo.
Si quieres que el carbono interaccione químicamente con el hidrógeno para formar metano, cuya fórmula es CH4, considera la estructura de Lewis de cada elemento.
El carbono, al estar en el grupo catorce, tiene cuatro electrones de valencia representados con puntos; el hidrógeno, al estar en el grupo uno, tiene un electrón de valencia, representado con una “X”.
Entonces, el carbono para completar su última órbita o nivel de energía con ocho electrones puede aceptar cuatro electrones de valencia que, en este ejemplo, compartirá con cada uno de los electrones de los cuatro átomos de hidrógeno; de esta manera logra su estabilidad alcanzando la configuración del neón y cumple así la regla del octeto. Lo anterior sucede porque el carbono tiene una valencia de 4, por lo que puede formar la molécula de metano CH4.
Como el hidrógeno tiene valencia de uno, entonces su único electrón de valencia que se encuentre en la órbita o nivel de energía, tiende a compartirlo con otro electrón de átomos iguales o diferentes para lograr su estabilidad. En este caso, comparte con los átomos del carbono, los correspondientes electrones de valencia de manera que logra la configuración del helio con dos electrones de valencia en su nivel de energía.
Recuerda que los átomos eléctricamente neutros cuentan con varias propiedades periódicas, una de ellas es el radio atómico.
El radio atómico se define como la mitad de la distancia ente dos núcleos atómicos adyacentes de un elemento.
Realiza la siguiente actividad para organizar a estos elementos de mayor a menor radio atómico, serian aluminio, calcio y cesio
Primero debes conocer qué es el radio atómico. El radio atómico se define como la mitad de la distancia entre 2 núcleos atómicos adyacentes de un elemento.
Observa de qué modo esta propiedad periódica depende de las interacciones entre el núcleo y los electrones de un átomo.
Recuerda que la tabla periódica de los elementos consta de 118 elementos reconocidos por la IUPAC (la unión internacional de química pura y aplicada, por sus siglas en inglés).
Para las siguientes actividades te enfocarás sólo en algunos de ellos. Observa la siguiente tabla, en la cual se muestran la mayoría de los elementos representativos, en particular, los grupos 1 y 2, así como los del 13 al 18, y los períodos del 1 al 6.
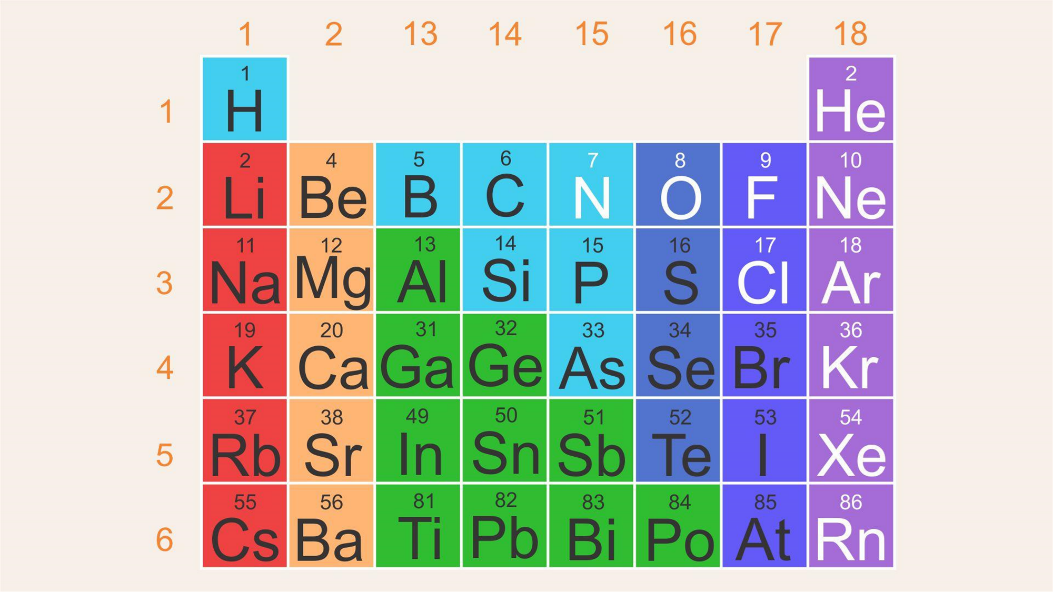
El radio atómico es una distancia, por lo tanto, tendrá unidades de longitud y como las distancias son tan pequeñas, empleas una unidad llamada picómetro (pm); esta es una unidad de longitud equivalente exactamente a la billonésima parte de un metro, que expresado en notación científica es de 1 x 10-12 m.
Por ejemplo, la bacteria del escherichia coli tiene una longitud de 2 x 10-3 picómetros.
Así como algunas bacterias son tan pequeñas, ¿cómo crees que son los tamaños de los radios atómicos de los elementos?
Analiza, el cesio tiene un radio atómico de 343 pm, el litio de 152 pm y el helio de 31 pm.

Observa qué le sucede al radio atómico de algunos elementos del segundo período al ir desplazándonos de izquierda a derecha.

Se tiene al litio en el grupo 1, período 2, con un radio de 152 pm.
Sigue con el berilio en el grupo 2, período 2, y un radio de 112 pm.
Ahora el boro, en el grupo 13, período 2, y un radio atómico de 85 pm.
¿Qué es lo que observas?
¿Qué sucede conforme te mueves a la derecha en el período? Disminuye el radio atómico.
Al aumentar el número de protones en el núcleo, también se agregan electrones para que el átomo sea eléctricamente neutro. En un mismo período los electrones se agregan en la misma capa, es decir, a la misma distancia del núcleo y, por lo tanto, al aumentar el número de protones en el núcleo aumenta la fuerza con la que el núcleo atrae a los electrones, ocasionando que disminuya el radio atómico.
Los radios atómicos de los elementos situados en el lado izquierdo de la tabla periódica son mayores que los radios atómicos de los elementos situados del lado derecho en un mismo período.
Ahora observa qué pasa con el radio atómico si se mueve del período 1 al período 6, dentro de un mismo grupo. Revisa el grupo 1.
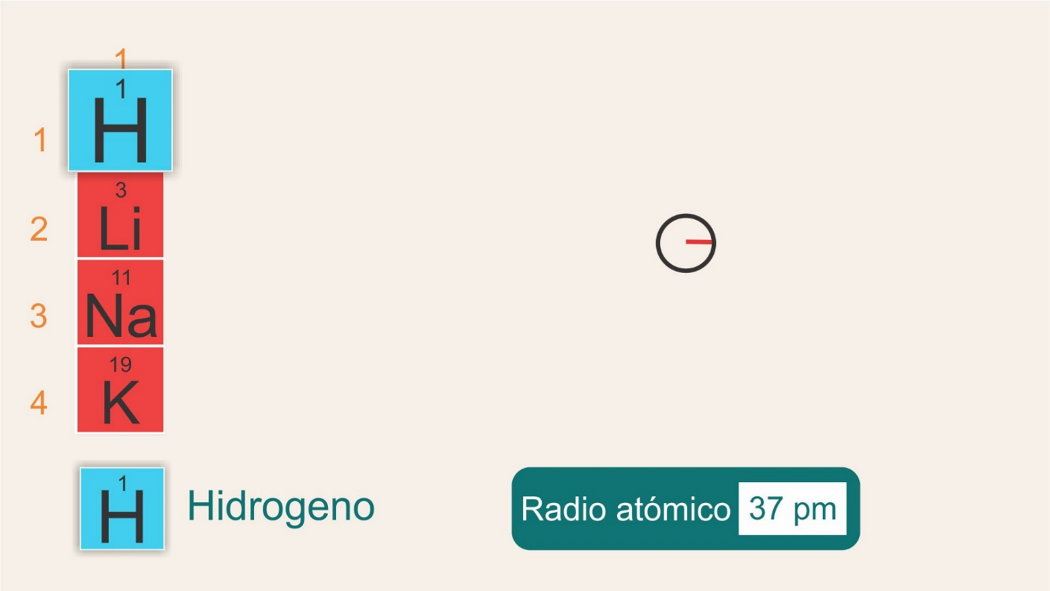
Tienes hidrógeno, situado en el grupo 1, período 1, con un radio de 37 pm.
Luego en el grupo 1, período 2, está el litio, con un radio atómico de 152 pm.
Después el sodio en el período 3, grupo 1, con un radio atómico de 186 pm.
¿Qué notas?
Que fue aumentando el radio atómico conforme ibas bajando de periodos dentro del mismo grupo.
En efecto, los radios atómicos de los elementos que se encuentran en la parte inferior de la tabla periódica normalmente son mayores a los radios de los elementos situados en la parte superior de la tabla.
Por eso el radio atómico es una de las propiedades periódicas de los elementos, ya que presenta cambios constantes y consistentes a lo largo de la tabla periódica. Esto lo pudiste observar en el aumento constante del radio al bajar en un mismo grupo y su disminución constante a lo largo de un mismo periodo.
Entonces, sólo por la posición de los elementos en la tabla periódica podrías saber qué elementos tienen mayor radio atómico. Por ejemplo, quedarían de mayor a menor radio atómico, el cesio, el calcio y el aluminio.
Imagínate el enlace entre átomos diferentes como una “lucha de tira y afloja” por los electrones de valencia . Para usar este modelo de reparto de electrones necesitas tener una forma de determinar la fuerza de atracción que ejerce cada átomo sobre los electrones compartidos, a la medida de esa fuerza se denomina electronegatividad.
La electronegatividad de un elemento se define como la capacidad relativa de un átomo para atraer electrones de otro átomo al enlazarse químicamente y formar un compuesto.
La electronegatividad es una propiedad periódica.
Observa la variación de la electronegatividad; ésta va aumentando de izquierda a derecha a lo largo de los períodos, y de abajo hacia arriba dentro de cada grupo.
Los valores de electronegatividad fueron asignados con base en una escala denominada “escala Pauling”.
Observa la siguiente tabla:
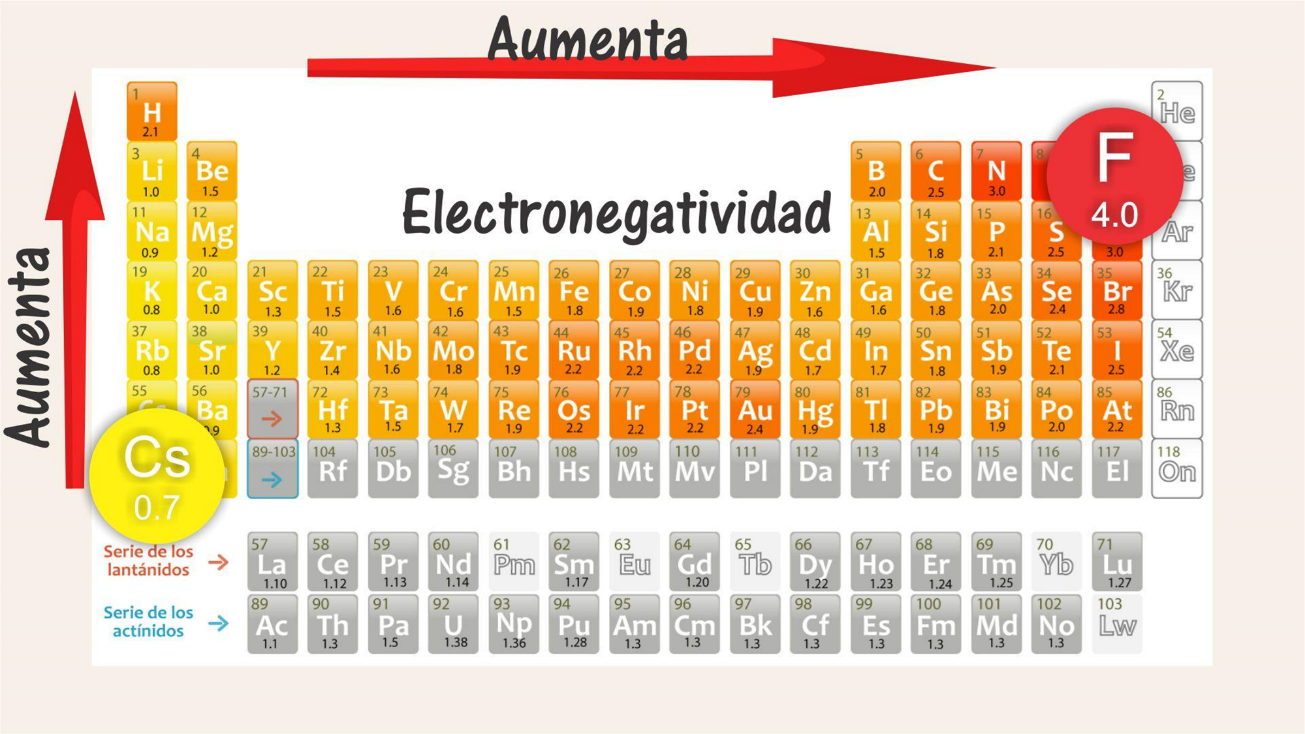
El elemento que presenta el valor más alto, es decir, mayor electronegatividad, es el flúor, que se localiza en el período 2, grupo 17, con 4 unidades Pauling; mientras que los valores más bajos, es decir, con menor electronegatividad, corresponden al cesio y al francio con 0.7 Pauling, cuyos elementos se localizan en el grupo 1, períodos 6 y 7 respectivamente.
¿Entonces quiere decir que la electronegatividad de los elementos en la tabla periódica va aumentando de izquierda a derecha y de abajo hacia arriba y por lo tanto disminuye de derecha a izquierda y de arriba hacia abajo?
Ordena de mayor a menor electronegatividad los siguientes elementos en la tabla periódica.
Los elementos son silicio, bario, oxígeno y galio.
Ubica cada elemento en la tabla periódica; observa que:
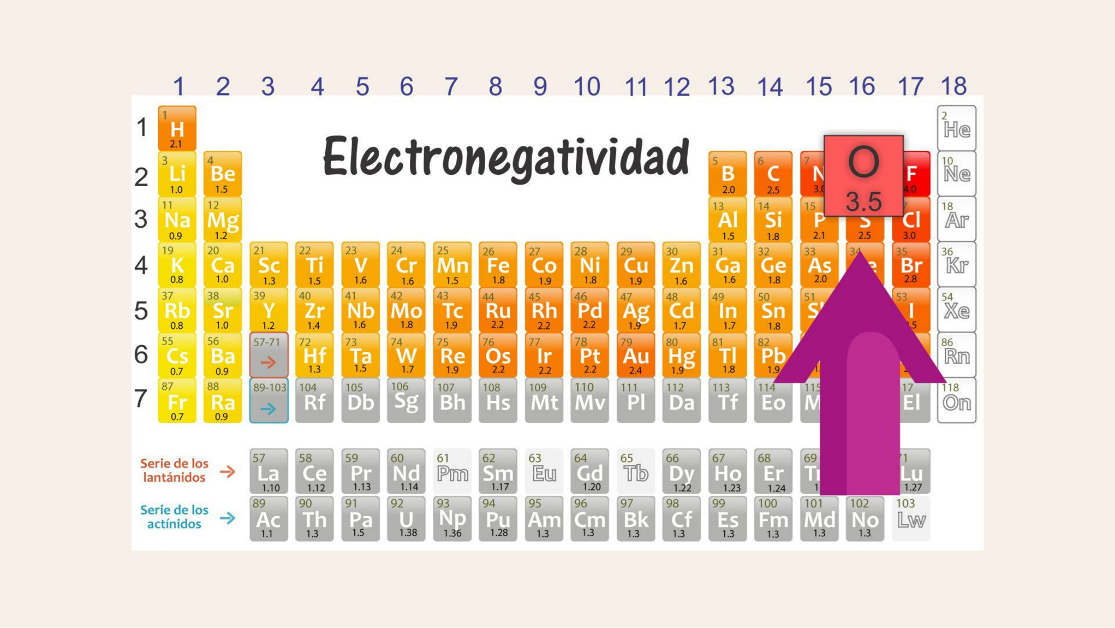
El oxígeno sería el de mayor electronegatividad ya que es el que está más arriba y a la derecha que los otros elementos en la tabla periódica. Luego sigue el silicio, porque está más a la derecha y hasta arriba que el bario y el galio.
El siguiente elemento sería el galio, que ubicas en la tabla periódica, está en el grupo 13, periodo 4, y el de menor electronegatividad sería el bario, por estar en el grupo 2, período 6, y en la tabla de electronegatividad a la izquierda y abajo, disminuyendo su valor de la electronegatividad.
No es tan difícil saber cuáles elementos tienen menor o mayor electronegatividad, sólo es cuestión de recordar hacia qué dirección aumenta o disminuye observando la tabla periódica.
La electronegatividad varía en forma periódica, puedes predecir la diferencia de electronegatividad que existe entre los átomos enlazados observando la distancia que los separa en la tabla. En general, mientras más separados se encuentren en la tabla periódica, mayor será la diferencia de electronegatividades entre los átomos.
Recuerda que en la formación de compuestos las diferencias de electronegatividades te pueden indicar qué tipo de enlace químico se está formando, ya sea una covalente polar, covalente no polar o iónico.
Esto tiene una consecuencia en la formación de compuestos, por ejemplo, se forma un enlace iónico entre dos elementos cuando la diferencia de electronegatividad es mayor a 1.7 en la escala de Pauling; tal es el caso del cloruro de sodio, buscas en la escala de Pauling el valor de la electronegatividad de los elementos involucrados, para este caso el sodio y el cloro.
Observa que el cloro tiene un valor en la escala de Pauling de 3.0 y el sodio de 0.9, al restar estos valores obtienes un resultado de 2.1, por lo que el enlace que se forma es iónico.
Linus Pauling se interesó desde muy joven por la naturaleza del enlace químico, inspirado por los artículos de Langmuir y los trabajos de Lewis acerca del comportamiento de los electrones entre átomos. Trabajó en Europa con Sommerfeld y Bohr.
Escribió varios libros, entre ellos La naturaleza del enlace químico.
Se interesó en campos tan diversos como la determinación de la estructura de los cristales, de las proteínas y de los anticuerpos, así como la de la hemoglobina. Por otro lado, luchó para que no hubiera guerras y se opuso a la utilización de armas nucleares. Obtuvo el Premio Nobel de Química en 1954 y el de la Paz, en 1965. Puede considerarse como uno de los químicos más destacados del siglo XX.
En esta sesión recordaste que la valencia es el número de enlaces que un átomo de cualquier elemento puede formar al unirse con otros átomos. La valencia de un elemento es la capacidad de combinación de un átomo con otro similar o diferente.
La tabla periódica permite predecir las propiedades de los elementos con sólo observar su posición dentro de ella, así como realizar comparaciones entre las diferentes propiedades de los elementos.
Por ejemplo, el radio atómico, que aumenta en los períodos de arriba hacia abajo dentro de los grupos y disminuye de izquierda hacia la derecha dentro de los períodos.
La electronegatividad, que utiliza la escala Pauling de 0 a 4. En la tabla periódica puedes observar cómo aumenta de izquierda a derecha y de abajo hacia arriba.
Se te sugiere que observes la sesión del día jueves 29 de octubre para tener más referencias de estos temas. Anota en tu quimi-glosario las ideas clave.
El reto de hoy:
Para que puedas reafirmar lo aprendido en esta sesión, se te propone llenar la siguiente tabla. En ella colocarás la valencia, el radio atómico y la electronegatividad.

Resuelve el primer elemento químico, que es el sodio; su valencia es de uno, su radio atómico es de 186 pm y su electronegatividad de 0.9, ahora continúa con el llenado de la tabla.
¡Buen trabajo!
Gracias por tu esfuerzo.

Login to join the discussion