6.21: Tendencias Periódicas- Electronegatividad
- Page ID
- 70531
¿Es fácil o difícil para ti hacer nuevos amigos?
¿Alguna vez has notado cómo algunas personas atraen a otras hacia ellas? Ya sea su personalidad, atractivo o habilidades atléticas, algo atrae a la gente hacia ellos; mientras que otros tienen un grupo más pequeño de amigos y conocidos. Los átomos hacen lo mismo. Un átomo puede atraer electrones fuertemente hacia él, mientras que un segundo tipo de átomo tiene mucho menos “poder de tracción”.
Electronegatividad
Los electrones de valencia de ambos átomos siempre están involucrados cuando esos dos átomos se unen para formar un enlace químico. Los enlaces químicos son la base de cómo los elementos se combinan entre sí para formar compuestos. Cuando se forman estos enlaces químicos, los átomos de algunos elementos tienen una mayor capacidad de atraer los electrones de valencia involucrados en el enlace que otros elementos.
La electronegatividad es una medida de la capacidad de un átomo para atraer los electrones cuando el átomo es parte de un compuesto. La electronegatividad difiere de la afinidad electrónica porque la afinidad electrónica es la energía real liberada cuando un átomo gana un electrón. La electronegatividad no se mide en unidades de energía, sino en una escala relativa. Todos los elementos se comparan entre sí, asignándose al elemento más electronegativo, el flúor, un valor de electronegatividad de 3.98. El flúor atrae los electrones mejor que cualquier otro elemento. En la siguiente tabla se muestran los valores de electronegatividad de los elementos.
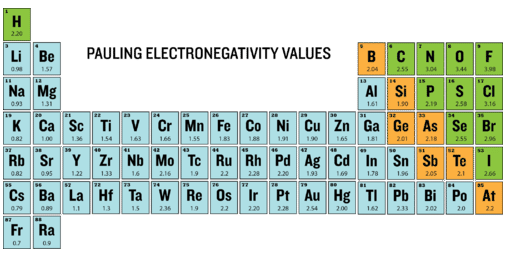
Dado que los metales tienen pocos electrones de valencia, tienden a aumentar su estabilidad al perder electrones para convertirse en cationes. En consecuencia, las electronegatividades de los metales son generalmente bajas. Los no metales tienen más electrones de valencia y aumentan su estabilidad al ganar electrones para convertirse en aniones. Las electronegatividades de los no metales son generalmente altas.
Tendencias
Las electronegatividades generalmente aumentan de izquierda a derecha a lo largo de un periodo. Esto se debe a un incremento en la carga nuclear. Los metales alcalinos tienen las electronegatividades más bajas, mientras que los halógenos tienen las más altas. Debido a que la mayoría de los gases nobles no forman compuestos, no tienen electronegatividades. Tenga en cuenta que hay poca variación entre los metales de transición. Las electronegatividades generalmente disminuyen de arriba a abajo dentro de un grupo, debido al mayor tamaño atómico.
De los elementos principales del grupo, el flúor tiene la mayor electronegatividad (EN\(= 4.0\)) y el cesio el más bajo (EN\(= 0.79\)). Esto indica que el flúor tiene una alta tendencia a ganar electrones de otros elementos con electronegatividades más bajas. Podemos usar estos valores para predecir qué sucede cuando ciertos elementos se combinan.
Cuando la diferencia entre las electronegatividades de los átomos es mayor que ~1.7, entonces se produce un intercambio completo de electrones. Normalmente este intercambio es entre un metal y un no metal. Por ejemplo, el sodio y el cloro típicamente se combinarán para formar un nuevo compuesto y cada ion se vuelve isoelectrónico con su gas noble más cercano. Cuando comparamos los valores EN, vemos que la electronegatividad para\(\ce{Na}\) es 0.93 y el valor para\(\ce{Cl}\) es 3.2. La diferencia absoluta entre ENs es\(\left| 0.93 - 3.2 \right| = 2.27\). Este valor es mayor a 1.7, y por lo tanto indica la aparición de un intercambio electrónico completo.
Resumen
- La electronegatividad es una medida de la capacidad de un átomo para atraer los electrones cuando el átomo es parte de un compuesto.
- Los valores de electronegatividad generalmente aumentan de izquierda a derecha a través de la tabla periódica.
- Las electronegatividades generalmente disminuyen de arriba a abajo de un grupo.
- El valor más alto de electronegatividad es para el flúor.
Revisar
- Definir “electronegatividad”.
- ¿En qué se diferencia la electronegatividad de la afinidad electrónica?
- ¿Por qué los valores de electronegatividad de los metales son generalmente bajos?
- Describir la tendencia de las electronegatividades a través de la tabla periódica.
- Describir las tendencias en electronegatividades en un grupo de la tabla periódica.


