8.8.2: Tabla de Electronegatividades
- Page ID
- 75652
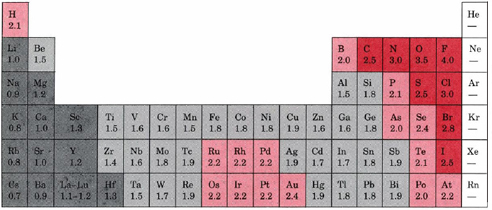
Datos de Linus Pauling. “La naturaleza del enlace químico”, 3d ed., Cornell University Press, Ithaca, N.Y., 1960.
Esta tabla muestra la derivación de las electronegatividades de Linus Pauling. Al flúor, el elemento más electronegativo, se le ha dado arbitrariamente un valor de 4.0. La electronegatividad de cada otro elemento se ha escalado en consecuencia.
Los elementos con electronegatividades de 2.5 o más son todos no metales en la esquina superior derecha de la tabla periódica. Estos han sido codificados por colores rojo oscuro. Por el contrario, los elementos con negatividades de l.3 o menos son todos metales en la parte inferior izquierda de la tabla. Estos elementos han sido codificados en gris oscuro. A menudo se les conoce como los elementos más electropositivos, y son los metales que invariablemente forman compuestos iónicos binarios. Entre estos dos extremos notamos que la mayoría de los metales restantes (principalmente metales de transición) tienen electronegatividades entre l.4 y l.9 (gris claro), mientras que la mayoría de los no metales restantes tienen electronegatividades entre 2.0y 2.4 (rojo claro). Otra característica que vale la pena destacar son las diferencias muy grandes en electronegatividades en la esquina superior derecha de la mesa. El flúor, con una electronegatividad de 4, es con mucho el elemento más electronegativo. A 3.5 el oxígeno es un segundo distante, mientras que el cloro y el nitrógeno se atan para el tercer lugar en 3.0.
Esta tabla se encuentra en Corechem:Electronegatividad.
Esta tabla se encuentra en la sección sobre Electronegatividad.


