1.6: La Tabla Periódica y Tendencias Periódicas
- Page ID
- 80677
El proceso aufbau es un conjunto de reglas que nos permite predecir la configuración electrónica de un átomo si sabemos cuántos electrones hay en el átomo. Si la tabla periódica se utiliza como herramienta, este proceso es bastante sencillo.
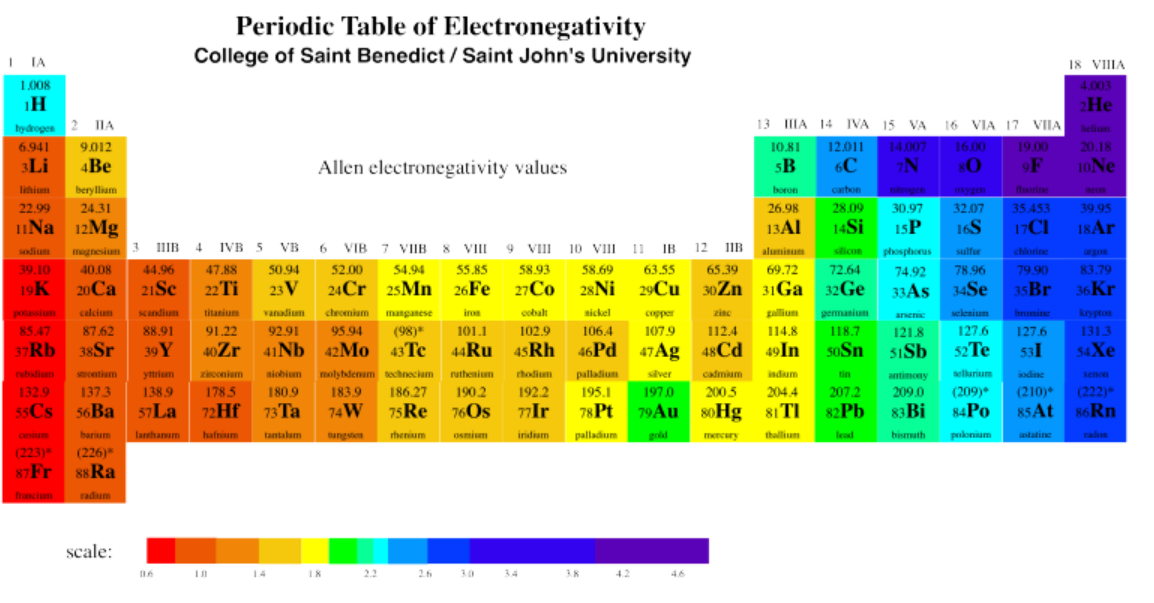
Para los átomos que se encuentran en las dos primeras columnas de la tabla periódica (figura\(\PageIndex{1}\)), la configuración es una capa cerrada de electrones centrales, más s electrones en una nueva capa. Por ejemplo, el potasio tiene una configuración [Ar] 4s 1. Estos átomos a menudo se denominan elementos alcalinos y alcalinotérreos. Los elementos alcalinos, de la primera columna, tienen una configuración que termina en s 1; los elementos alcalinotérreos, de la segunda columna, tienen configuraciones que terminan en s 2. Juntos, a estos elementos se les suele llamar los elementos del bloque s, porque sus electrones de valencia son electrones s. Recuerden, los electrones de valencia son los que están más allá del núcleo del gas noble. En el caso del potasio, son los que están más allá de [Ar].
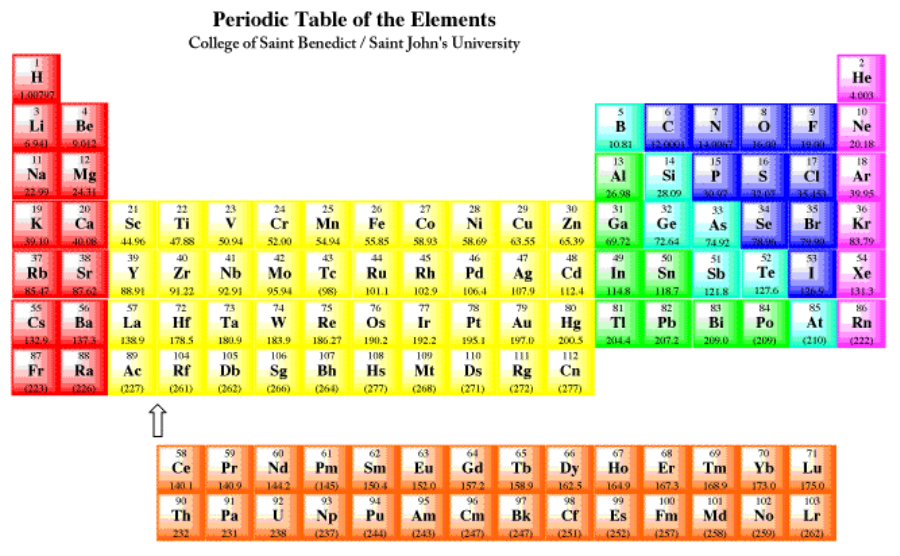
Las dos primeras y las últimas seis columnas de la tabla periódica se denominan elementos del grupo principal. Alternativamente, a veces se les llama elementos s-block y p-block, respectivamente. Por ejemplo, el fósforo tiene una configuración, [Ne] 4s 2 4p x 1 p y 1 p z 1, o simplemente [Ne] 4s 2 4p 3.
El bloque medio de la tabla periódica consiste en los metales de transición o los elementos del bloque d. Por ejemplo, el escandio tiene configuración [Ne] 4s 2 3d 1.
Las dos últimas filas de la tabla periódica son los lantánidos y actínidos. Colectivamente, se les llama los elementos f-block. El samario, por ejemplo, es [Xe] 6s 2 4f 6. Estos elementos realmente podrían insertarse en el lado izquierdo del bloque d en las filas apropiadas. Observe que el lantano, elemento 57, es seguido por el hafnio, elemento 72, en la tabla. El elemento que realmente ocurre a continuación es el elemento 58, cerio, y se muestra en la fila de lantánidos abajo. Los elementos del bloque f generalmente se muestran a continuación con el fin de ahorrar espacio.
Realmente, la tabla periódica debería verse así:
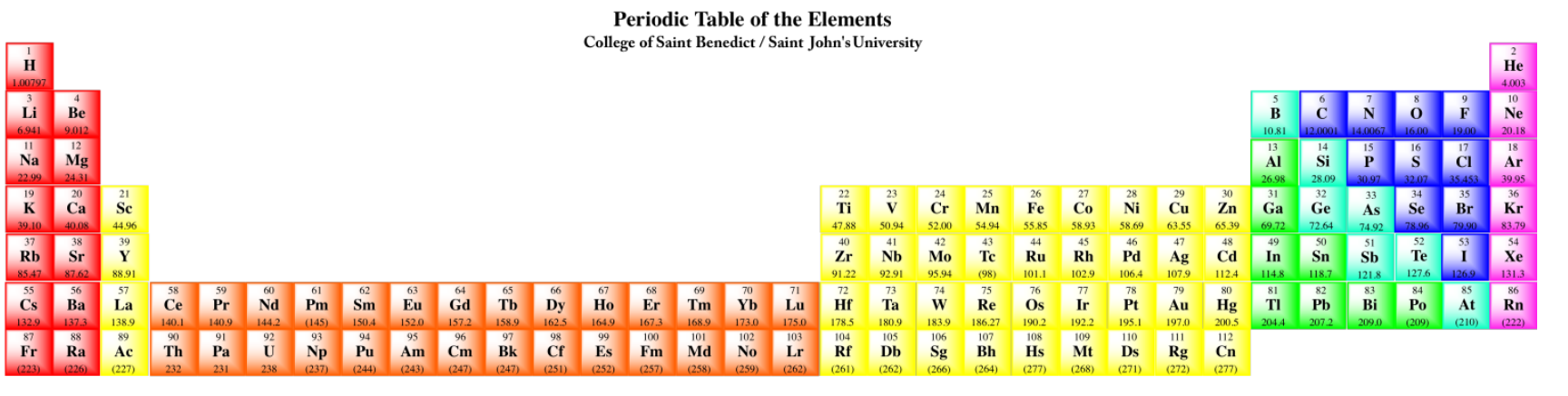
- La tabla periódica se divide en columnas de átomos con configuraciones de electrones similares.
- Los átomos con configuraciones de electrones similares tienen propiedades similares.
Las reacciones químicas dependen del movimiento de los electrones. En una reacción, un átomo puede aceptar electrones de otro átomo. Un átomo puede donar electrones a otros átomos. Los electrones de valencia son los electrones más externos en un átomo; están más cercanos a la superficie de un átomo. Ese hecho hace que los electrones de valencia sean más propensos a interactuar con otros átomos. La valencia también son los electrones de mayor energía en un átomo, y con mayor probabilidad de participar en una reacción.
Por estas razones, los átomos con configuraciones de electrones similares generalmente se comportan de manera similar. Las propiedades de repetición en cada fila de la tabla periódica, según lo observado por Mendeleev y otros, reflejan las configuraciones de electrones repetidos en filas posteriores. La tabla periódica organiza átomos con configuraciones y propiedades similares juntos en columnas.
Para los siguientes elementos, sugiera otros dos elementos que tendrían propiedades similares.
a) zinc, Zn b) calcio, Ca c) oxígeno, O d) cloro, Cl e) cromo, Cr
- Respuesta a:
-
Zn: Cd, Hg
- Respuesta b:
-
Ca: Mg, Ba
- Respuesta c:
-
O: S, Se
- Respuesta d:
-
Cl: F, Br
- Respuesta e:
-
Cr: Mo, W
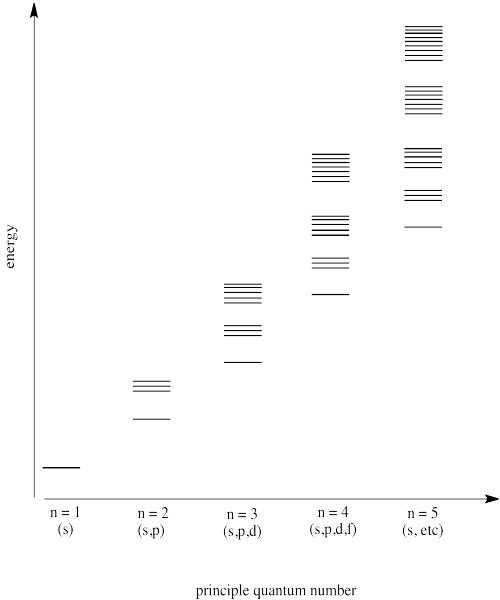
Hacer un diagrama que muestre los niveles de energía de diferentes orbitales, dispuestos por número cuántico principal.
Contestar
Las “tendencias periódicas” se refieren a la forma en que las propiedades físicas de los átomos cambian a través de la tabla periódica. Una de las tendencias periódicas más utilizadas en química es la electronegatividad. La electronegatividad está estrechamente relacionada con la idea básica de las reacciones químicas: la transferencia de un electrón de un átomo neutro a otro. Se refiere a cuán fuertemente un átomo atrae electrones de otros átomos.
- La electronegatividad es una medida de la capacidad de un átomo para atraer electrones hacia sí mismo, o la capacidad del núcleo para retener electrones firmemente.
Existen muchas escalas de electronegatividad, basadas en diferentes medidas físicas. Por lo general, la electronegatividad se establece en una escala de aproximadamente 4 puntos. Los átomos con electronegatividad de alrededor de 4 dibujan electrones muy fuertemente hacia ellos mismos. Los átomos con electronegatividad de 1 (o inferior) solo atraen débilmente electrones hacia ellos mismos.
Los siguientes datos utilizan la escala Allen de electronegatividad. La escala Allen utiliza mediciones espectroscópicas para estimar la energía de los electrones de valencia en un átomo. A partir de estos valores, la atracción relativa del átomo por sus electrones de valencia se coloca en una escala de 4 puntos (aproximadamente).
Cuadro\(\PageIndex{1}\): Los valores de electronegatividad Allen de los elementos de la segunda fila.
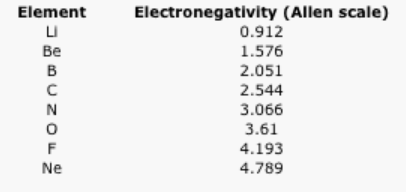
Algunas escalas de electronegatividad no tienen valores para los gases nobles, porque se basan en mediciones experimentales de compuestos, y los gases nobles no suelen formar compuestos con otros elementos. En cambio, existen como átomos individuales. La escala Allen solo depende de la capacidad de un átomo para interactuar con la luz, que es algo que incluso los gases nobles pueden hacer. Como resultado, a los gases nobles también se les dan valores de electronegatividad en esta escala. Sin embargo, en muchas escalas, el flúor sería el átomo más electronegativo aquí. Como resultado, el flúor suele considerarse como el elemento más electronegativo.
A menudo es útil trazar datos en una gráfica. De esa manera, podremos echar un mejor vistazo a la relación. Por ejemplo, un rápido vistazo a la Figura AT5.2. muestra que hay un incremento suave en la electronegatividad a medida que nos movemos a través de una fila en la tabla periódica.
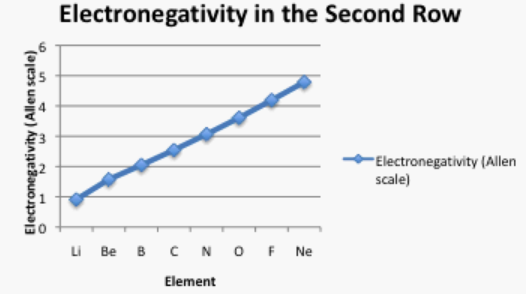
Echa un vistazo a la gráfica en la figura\(\PageIndex{3}\). ¿Se puede explicar por qué la electronegatividad aumenta a medida que aumenta el número atómico?.
- Contestar
-
El número atómico es el número de protones en el núcleo. Para dos átomos en la misma fila de la tabla periódica, los electrones más externos están aproximadamente a la misma distancia del nucelus. Cuantos más protones positivos haya en el núcleo, más fuertemente retenidos están los electrones.
Supongamos que necesitas un electrón. Tienes un átomo de boro y un átomo de oxígeno. Intentas quitarle un electrón a uno. Use Figura\(\PageIndex{3}\). para predecir qué átomo cederá el electrón más fácilmente.
- Contestar
-
Tómalo del boro. El átomo de oxígeno sostiene sus electrones con mucha más fuerza.
Supongamos que tienes un electrón. Usted es capaz de enviarlo a un recipiente que contiene un átomo de carbono y un átomo de flúor. Use Figura\(\PageIndex{3}\). para predecir qué átomo es más probable que tome el electrón.
- Contestar
-
Según el dibujo, el neón tomaría el electrón, debido a que de todos los átomos representados en la gráfica, el neón atrae con mayor fuerza a los electrones. Sin embargo, hay una complicación. Aunque el neón atrae fuertemente a sus propios electrones, no puede acomodar un electrón extra tan fácilmente como lo podría hacer el flúor, el siguiente mejor candidato. En términos de “Lewis”, el neón tiene un “octeto completo”. En términos cuánticos, un electrón adicional tendría un número cuántico principal mayor y se colocaría en la siguiente “concha”, más lejos del núcleo. Con el emparejamiento de espinas, el flúor puede aceptar otro electrón en su caparazón de valencia.
Un enlace químico covalente es un par de electrones compartidos entre dos átomos. Supongamos que tiene un enlace carbono-oxígeno. ¿Se compartirán los electrones de manera uniforme entre los dos átomos, o un átomo tirará de los electrones más fuertemente hacia sí mismo? Usa\(\PageIndex{3}\) Figura. para hacer tu predicción.
- Contestar
-
El oxígeno tiraría de los electrones en el enlace más fuertemente hacia sí mismo.
¿Qué sucede a medida que nos movemos a través de una fila en la tabla periódica? ¿Por qué aumenta la electronegatividad?
Hay que tener en cuenta que la única diferencia de un elemento al siguiente es el número de protones en el núcleo. Al número de protones se le llama el número atómico. Si conoces el número de protones que tienes, entonces sabes qué átomos tienes. La electronegatividad puede tener algo que ver con el número de protones en el núcleo. De hecho, debería. Cuantos más protones haya en el núcleo, más fuertemente deberían atraerse los electrones hacia él. Cada protón adicional debería agregar más atracción electrostática para un electrón. El flúor, con nueve protones, debería atraer electrones mucho más fuertemente que el litio, que sólo tiene tres protones.
- Moviéndose a través de una fila de la tabla periódica, a medida que se agregan protones al núcleo, los electrones se mantienen más apretados.
- La electronegatividad aumenta a lo largo de una fila en la tabla periódica.
Parece que ese efecto debería ser compensado por el creciente número de electrones en el átomo. Cada vez que se agrega un protón, también lo es un electrón. Ese electrón debería repeler a otros electrones en el átomo, cancelando el efecto de más protones en el núcleo.
Sin embargo, la estructura del átomo minimiza un poco la repulsión electrón-electrón. Recuerden que todos los protones están en un solo lugar, el núcleo. Todos los electrones están a una distancia relativamente grande del núcleo, en muchas direcciones diferentes. Lo más probable es que un electrón adicional esté mucho más lejos; puede estar el doble de lejos que un protón adicional en el núcleo. Puede estar todo el camino al otro lado del átomo. Debido a que los electrones están dispersos en el átomo, y las distancias entre ellos son bastante grandes, el efecto repulsivo es un poco menor que el efecto atractivo de los protones adicionales.
Podemos ver que esta tendencia es generalmente cierta a través de la tabla periódica, con algunas excepciones aquí y allá.
¿Qué sucede a medida que bajamos una columna en la tabla periódica? Tabla\(\PageIndex{2}\). muestra las electronegatividades Allen de los metales alcalinos. Estos elementos también se denominan elementos del Grupo 1 o los elementos del Grupo IA. Se utiliza la designación “Grupo 1" porque son la primera columna o grupo de la tabla periódica. Los datos también se presentan en la Figura\(\PageIndex{5}\).
Cuadro\(\PageIndex{2}\): Los valores de electronegatividad Allen de los elementos alcalinos.
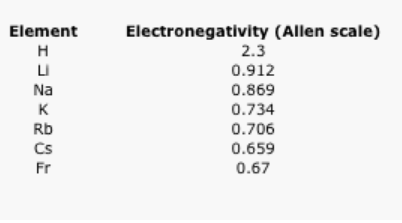
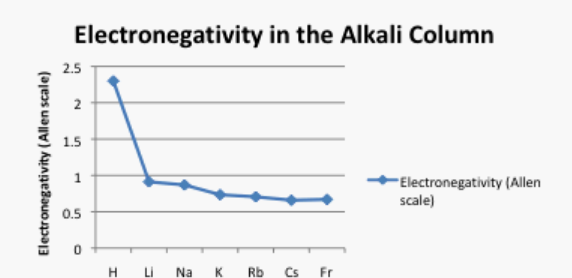
Aquí hay una tendencia diferente. En este caso, el litio (número atómico 3) tiene más protones que hidrógeno (número atómico 1). Sin embargo, el hidrógeno es mucho más electronegativo que el litio. El francio, con 87 protones en su núcleo, es el elemento alcalino menos electronegativo.
Eche un vistazo a la gráfica de la Figura\(\PageIndex{5}\). ¿Puedes explicar por qué la electronegatividad disminuye a medida que aumenta el número atómico, bajando por esta columna?
- Contestar
-
Pasar de una fila a la siguiente en la tabla periódica significa que el electrón más externo está en una concha más alejada del núcleo. Esos electrones más externos están menos apretados si están más alejados del núcleo.
Un enlace químico iónico es un par de iones atraídos por sus cargas opuestas. Un catión es un ion cargado positivamente; puede ser un átomo que ha perdido un electrón. Un anión es un ion cargado negativamente; puede ser un átomo que ha ganado un electrón extra. Los iones se pueden formar moviendo un electrón de un átomo a otro.
- Supongamos que tiene un enlace iónico cesio-flúor. ¿Qué ion es el cesio y cuál es el flúor? Usa Figura\(\PageIndex{3}\) y Figura\(\PageIndex{5}\). para hacer su predicción. El cesio es Cs.
- Supongamos que tiene un enlace iónico sodio-oxígeno. ¿Qué ion es el sodio y cuál es el oxígeno? Usa Figura\(\PageIndex{3}\) y Figura\(\PageIndex{5}\). para hacer su predicción. El sodio es Na (del latín, el sodio).
- Supongamos que tiene un enlace iónico-potasio hidrógeno. ¿Qué ion es el potasio y cuál es el hidrógeno? Usa Figura\(\PageIndex{3}\) y Figura\(\PageIndex{5}\). para hacer su predicción. El potasio es K (del latín, kalium).
- Respuesta a:
-
Cs + F-
- Respuesta b:
-
Na + O -
- Respuesta c:
-
K + H -
Tendencias Periódicas y Radio Atómico
La mayor diferencia entre dos átomos en el mismo grupo (columna) en la tabla periódica es el número cuántico principal. Recuerda, eso corresponde al “caparazón de valencia”. Piense en los electrones como capas formadoras alrededor del núcleo. Los electrones con el cuántico principal número uno forman una primera capa. Aquellos con el número cuántico principal 2 forman una segunda capa, y así sucesivamente. Cada capa está más alejada del núcleo. Recuerde, la atracción electrostática se debilita a medida que las cargas se alejan más unas de otras. A medida que los electrones se alejan del núcleo, se mantienen menos apretados.
- Al bajar una columna de la tabla periódica, los electrones de valencia se mantienen con menos fuerza porque se alejan del núcleo.
- La electronegatividad disminuye a medida que bajamos una columna en la tabla periódica.
Podemos ver esta tendencia general del tamaño en la siguiente tabla periódica. En esta tabla se presentan los radios covalentes, los cuales están relacionados con los tamaños de los átomos (aunque no exactamente lo mismo; no se dispone de datos sobre radios atómicos para todos los átomos, sin embargo).
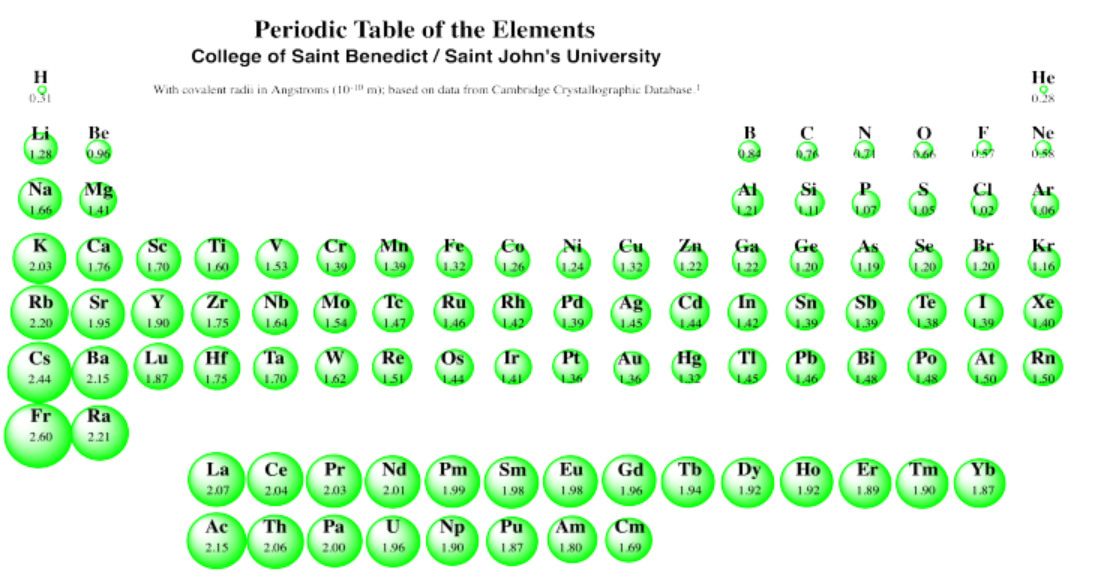
Podemos ver claramente los radios de expansión de los átomos si miramos al Grupo 1, la primera columna; estos elementos se llaman los metales alcalinos. El hidrógeno, en la parte superior, es muy pequeño. El litio es mucho más grande. Sin embargo, el sodio es mucho más grande que el litio y el potasio es mucho más grande que el sodio. Y así sucesivamente: el francio es más grande que el cesio, que es más grande que el rubidio, que es más grande que el potasio.
Cada vez que se agrega un electrón a un orbital que se encuentra significativamente más lejos del núcleo, por supuesto que va a resultar en un átomo más grande. Recuerde, el átomo es mayormente espacio vacío, y su tamaño es descrito por los alcances más externos de sus electrones. Entonces, cuando vamos al siguiente número cuántico principal —es decir, a la siguiente fila de la tabla periódica, de la primera fila a la segunda fila, por ejemplo— el siguiente electrón está mucho más lejos del núcleo. Tiene que ser así, porque los electrones se repelen entre sí. No todos pueden estar igual de cerca del núcleo, porque habría demasiada repulsión. En cambio, forman estas capas, y cuando la primera capa está tan llena que habría demasiada repulsión si se agregara otro relectron, comenzamos la siguiente capa.
Por supuesto, la primera capa es muy, muy pequeña. Simplemente no hay tanto espacio tan cerca del núcleo. Para la primera fila, sólo se permiten dos electrones. Entonces tienen que iniciar la siguiente capa. Para la segunda fila, se permiten ocho electrones; ese es el origen de algo llamado la “regla del octeto” (piense en “pulpo”) para compuestos comunes, que verás más adelante. Eventualmente llegamos a dieciocho electrones en un caparazón, luego treinta y dos, a medida que las conchas se hacen cada vez más grandes como capas de una cebolla, o como muñecas rusas anidadas.
Hay otra tendencia importante si miras con atención. A medida que te mueves de izquierda a derecha a través de la tabla periódica, de un grupo al siguiente, los átomos se hacen más grandes. Eso no tiene ningún sentido, ¿verdad? Si estamos agregando más electrones, ¿por qué el átomo se haría más pequeño?
Lo clave es que no sólo estamos agregando más electrones, sino que también estamos agregando más protones en el núcleo. Los nuevos electrones que estamos agregando son todos aproximadamente equidistantes del núcleo; todos están igualmente cerca de los protones. Entonces a medida que la carga en el núcleo se hace más grande, esos electrones son todos más fuertemente atraídos hacia el centro. El átomo se encoge.
Finalmente, llegamos al punto en el que no podríamos añadir más electrones; el radio se ha reducido tanto que la repulsión se volvería demasiado grande si añadimos un electrón más. Entonces apenas empezamos otra fila. Justo antes de ese punto, sin embargo, llegamos a un punto óptimo: el punto en el que la atracción entre el núcleo y los electrones más externos es tan fuerte, y los electrones se sujetan con tanta fuerza, que el átomo se vuelve muy, muy estable. Esta última columna de la tabla contiene los gases nobles, los cuales son particularmente estables y no reactivos.
¿Por qué cae tan bruscamente la electronegatividad entre el hidrógeno y el litio, y mucho más sutilmente entre el litio y el sodio?
- Contestar
-
La atracción por un electrón cae con 1/r 2. A medida que el valor de r se hace cada vez más grande, la cantidad 1/r 2 comenzará a acercarse a un límite (de cero). Como resultado, la diferencia entre dos valores sucesivos de 1/r 2 en una serie se hace cada vez más pequeña.
¿Qué átomo, en los siguientes pares, es más electronegativo?
- magnesio, Mg o calcio, Ca
- plomo, Pb o estaño, Sn
- plata, Ag o antimonio, Sb
- galio, Ga o arsénico, As
- tungsteno, W, o cobre, Cu
- talio, Tl, o azufre, S
- Respuesta a:
-
Mg > Ca
- Respuesta b:
-
Sn > Pb
- Respuesta c:
-
Sb > Ag
- Respuesta d:
-
As > Ga
- Respuesta e:
-
Cu > W
- Respuesta f:
-
S > Tl
La ionización de electrones es la energía que se debe agregar para alejar un electrón de un átomo.
- ¿Por qué crees que se tiene que usar la energía para alejar un electrón de un átomo? ¿Qué es lo que sostiene el electrón ahí?
- Explique la tendencia general en las energías de ionización que se ve en la siguiente tabla (un valor mayor significa que se debe agregar más energía para eliminar un primer electrón del átomo).
- Respuesta a:
-
El electrón es retenido por su atracción hacia el núcleo.
- Respuesta b:
-
A medida que aumenta el número de protones en el núcleo, el electrón se sujeta más firmemente y se vuelve más difícil de eliminar.
La relación es similar a la que se ve para la electronegatividad, y no casualmente. La electronegatividad se puede calcular de varias maneras, pero una de esas formas utiliza la energía de ionización como factor.
La electronegatividad es un valor calculado, mientras que la energía de ionización es una determinada experimentalmente. Esta diferencia trae consigo una importante distinción filosófica. Para un estudiante principiante, un valor experimental parece defectuoso, mientras que un valor calculado suena bien. Para un químico experimentado, un valor experimental es verificable; es real. En contraste, un valor calculado se potencia en prestigio sólo si se puede demostrar que concuerda con el experimento.
Cuadro\(\PageIndex{3}\): Las energías de ionización de los elementos de la segunda fila.
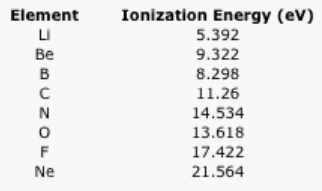
A veces una gráfica de los datos puede ser reveladora. Las energías de ionización no siguen una tendencia suave. Explique por qué es un poco más fácil eliminar un electrón del boro y el oxígeno de lo esperado. (Las configuraciones de electrones pueden ser útiles aquí).
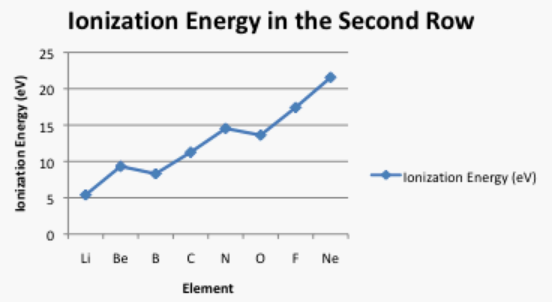
Figura\(\PageIndex{7}\): Gráfica de las energías de ionización de los elementos de la segunda fila.Respuestapara escapar del átomo, un electrón debe ganar energía. Como se muestra en el problema Ejercicio\(\PageIndex{2}\), el nivel de energía 2p es mayor que el nivel de energía 2s. Eso significa que un electrón 2p ya tiene más energía que un electrón 2s. El electrón 2p no necesitará tanta energía adicional para poder escapar del átomo. Como resultado, la energía de ionización del boro es un poco menor que la del berilio. Los protones adicionales en el núcleo de carbono y nitrógeno compensan con creces ese efecto.En el caso del oxígeno, el siguiente electrón solo se agrega a un nivel 2p, pero en este caso debe ser emparejado con otro electrón en la misma región del espacio (en el mismo “orbital”). La repulsión entre estos electrones, o “energía de emparejamiento”, desestabiliza ligeramente el oxígeno, por lo que se necesitará menos energía para eliminar un electron.Una vez más, la adición continua de protones adicionales eventualmente compensa este efecto de emparejamiento.
Explicar la tendencia en los siguientes datos sobre la energía de ionización.
Cuadro\(\PageIndex{4}\): Las energías de ionización de los elementos alcalinos.
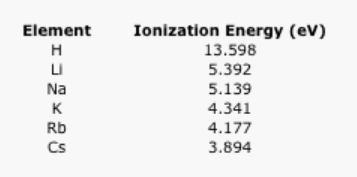
- Contestar
RespuestaComo con electronegatividad, la energía de ionización disminuye a medida que aumenta la distancia al núcleo debido a la relación 1/r2 en la Ley de Coulomb.
La afinidad electrónica es la energía liberada cuando un electrón libre es captado por un átomo.
- ¿Por qué se liberaría energía cuando un electrón libre es tomado por un átomo?
- Explicar la tendencia general en los siguientes datos de afinidad electrónica.
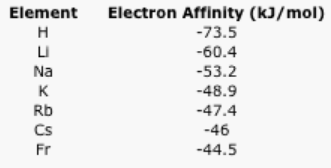
Respuesta a:- Respuesta b:
Cuadro\(\PageIndex{5}\): Las afinidades electrónicas de los elementos alcalinos.Respuesta A:La energía se libera debido a la atracción del electrón libre hacia un núcleo. El electrón se mueve para disminuir la energía a medida que se estabiliza por su interacción con el núcleo.Respuesta B: El electrón puede acercarse mucho más al núcleo de hidrógeno que al núcleo de litio, y así sucesivamente. Se liberará más energía debido a la fuerte interacción entre el electrón y el núcleo de hidrógeno en comparación con la interacción entre el electrón y el núcleo de litio (o sodio o potasio...).
- Explicar una tendencia general en los siguientes datos de afinidad electrónica.
- Hay varias excepciones a la tendencia general. ¿Por qué el berilio y el neón tienen tan bajas afinidades electrónicas (casi cero)?
- El nitrógeno también tiene una afinidad electrónica que es cercana a cero. ¿Por qué?
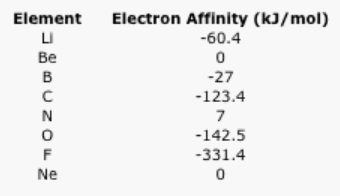
- Respuesta a:
- Respuesta b:
- Respuesta c:
Respuesta A: los datos zig-zags, pero en términos generales hay un aumento en la afinidad electrónica a medida que aumenta el número de protones en el núcleo.Respuesta b:El berilio y el neón tienen afinidad electrónica cero porque el siguiente electrón en cada caso se agregaría a un nivel de energía superior. En el caso del berilio, el siguiente electrón entraría en el nivel de energía 2p. Un electrón agregado al neón entraría en el nivel de energía 3s.Respuesta C:Aunque el siguiente electrón agregado al nitrógeno se agregaría a un nivel de 2p, tendría que ser emparejado en la misma región del espacio como un electrón que ya estaba ahí. La energía de emparejamiento en este caso debe ser suficiente para compensar la atracción del electrón hacia el núcleo.
Por lo general, los elementos se hacen más grandes a medida que bajamos una columna en la tabla periódica. Sin embargo, en un fenómeno llamado “la contracción de lantánidos”, algunos elementos son en realidad más pequeños que los que están en la fila por encima de ellos. Específicamente, el osmio, el iridio, el platino, el oro y el mercurio son más pequeños que sus parientes, rutenio, rodio, paladio, plata y cadmio, respectivamente.
Utilice la tabla periódica de la Figura\(\PageIndex{2}\). para ofrecer una posible explicación de este fenómeno.
- Contestar
-
Quizás la explicación más simple es esta: La adición de 14 protones extra entre lantano y hafnio, en comparación con entre itrio y circonio, da como resultado una contracción considerable del átomo. Los electrones son arrastrados hacia adentro por la carga positiva añadida en el núcleo. Así, los elementos de la tercera fila del bloque de metal de transición no son tan grandes como se podría esperar de otra manera, y en algunos casos son incluso más pequeños que sus elementos precedentes.
Tenga en cuenta que esta no es la única explicación. También se cree que los efectos relativistas juegan un papel en el comportamiento de estos elementos masivos. La teoría de la relatividad de Einstein establece que los objetos se vuelven más pesados cuanto más rápido se mueven. Se puede demostrar que la velocidad de un electrón aumenta con la carga en el núcleo del átomo. Así, los átomos que tienen números atómicos muy altos tienen electrones muy, muy rápidos, y en consecuencia muy pesados. Estos electrones pesados se hunden hacia el núcleo pesado, y el átomo se contrae aún más.

