Clasificación de los elementos: metales, no metales y metaloides
La tabla periódica se divide en dos grandes grupos metales y no metales, un tercero donde se encuentran los metaloides.
Clasificación general.
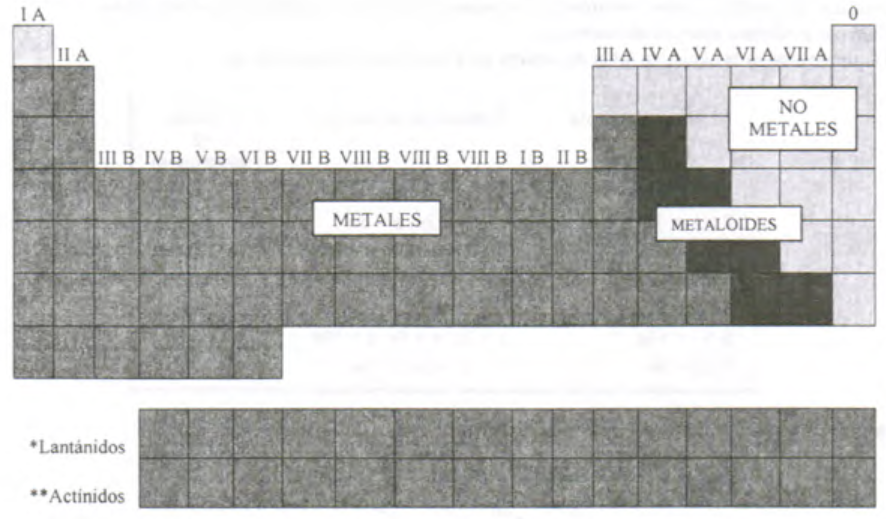
Ilustración 2 Clasificación general
| Sustancia | Propiedad física | Propiedad química |
| Metal | Tienen brillo. Son maleables. Dúctiles. Tenaces. Conducen la electricidad y el calor. Todos son sólidos menos el Hg. Se combinan entre sí formando Aleaciones |
Pierden electrones (electropositivos). + O2 = Óxido. + H2O = Hidróxidos. + Ácido = Sal. Moléculas monoatómicas. Son agentes reductores. |
| No metal | No tienen brillo. No son maleables. No son dúctiles. |
Ganan electrones (electronegativos). + O2 = Anhídridos. + H2O = Ácidos. + Base = Sal. Forman moléculas diatómicas Cl2, O2, N2, o poliatómicos P5, S8. Son agentes oxidantes. |
| Metaloide | B, Si, Ge, As, Sb, Te, Po. Sólidos. Tienen brillo metálico. Son semiconductores de la electricidad. Son malos conductores de calor. |
Exhiben propiedades metálicas y no metálicas, dependiendo de las condiciones en las que reaccionan. |
Clasificación por familias.
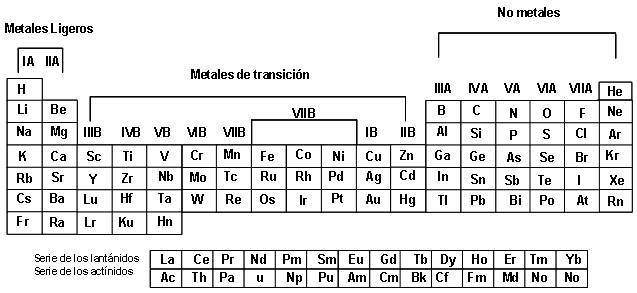
Conceptos
Grupo o familia.
Son las columnas y nos indican el número de electrones en el último nivel de energía de un elemento.
Periodo.
Son las filas, y nos indican el último nivel de energía que ocupan los electrones de un elemento.
Valencia.
La capacidad para combinarse, donde puede perder (+) o ganar electrones (-) para cumplir con la regla del octeto.
Electrones de valencia
Son el número de electrones de la última capa o nivel energético.
Regla del octeto.
Para que un elemento sea estable debe tener 8 electrones en el último nivel de energía (configuración de gas noble).
De acuerdo con las definiciones anteriores, si se tiene la siguiente configuración:
1s2 2s2 2p2
Este elemento pertenece a la familia IV A, periodo 2 y puede tener una valencia +4 ó -4 por la familia en la que se encuentra.
| Grupo A | Nombre | Electrones de valencia | Valencia representativa |
| I A | Metales alcalinos | 1 | +1 |
| II A | Metales alcalino-térreos | 2 | +2 |
| III A | Boro – Aluminio | 3 | +3 |
| IV A | Carbono | 4 | -4 |
| V A | Nitrógeno | 5 | -3 |
| VI A | Calcógenos | 6 | -2 |
| VII A | Halógenos | 7 | -1 |
| VIII A | Gases nobles o inertes | 8 | 0 |
| Grupo B | Nombre |
| I – VIII B | Metales de transición |
| 57 – 71 | Lantánidos |
| 89 – 103 | Actínidos |
Estructuras de Lewis
El grupo o familia, indican el número de electrones que se encuentran en el último nivel de energía, por lo tanto, si un elemento pertenece a la familia IA, este tendrá un electrón en el último nivel de energía (electrones de valencia). Estos electrones de valencia se pueden representar a través de las configuraciones puntuales o estructura de Lewis, que consiste en escribir el símbolo del elemento alrededor del cual se colocan los puntos que representan los electrones de valencia. Ejemplo:
| Familia | Electrones de valencia | Estructura de Lewis | Familia | Electrones de valencia | Estructura de Lewis |
| I A | 1 | 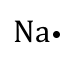 |
V A | 5 |  |
| II A | 2 | 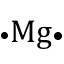 |
VI A | 6 |  |
| III A | 3 |  |
VII A | 7 |  |
| IV A | 4 | 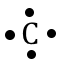 |
VIII A | 8 |  |
Propiedades periódicas
Electronegatividad y tipos de enlace: iónico y covalente
Electronegatividad.
Capacidad que tiene un átomo para atraer electrones en un enlace.
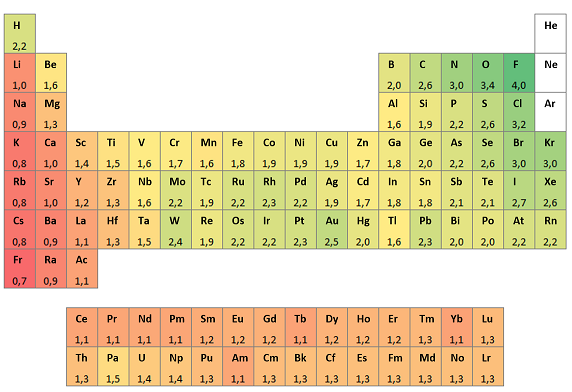
De la tabla anterior se puede observar lo siguiente:
- La electronegatividad aumenta de izquierda a derecha (se produce al aumentar la carga nuclear y el número de electrones presentes en el último nivel).
- La electronegatividad disminuye de arriba hacia abajo en los grupos (se debe al aumento de la distancia del núcleo a los electrones de enlace, la fuerza de atracción disminuye).
- Los metales poseen electronegatividades bajas.
- Los no metales poseen electronegatividades altas.
- El flúor es el átomo más pequeño del grupo VII, tiene la electronegatividad más alta de todos los elementos; el francio es el átomo más grande del grupo I tiene la electronegatividad más pequeña.
- Entre los metales de transición se observan discrepancias, pero son más o menos constantes.
Potencial de ionización (Energía de ionización)
Es la energía necesaria para separar un electrón de un átomo que está aislado, en estado gaseoso y en su estado base de energía. (Proceso endotérmico).
Afinidad electrónica
Es la energía que se libera o se absorbe cuando se agrega un electrón a un átomo gaseoso neutro en su estado basal. (Proceso exotérmico).
Enlace
Fuerza que mantiene juntos a grupos de dos o más átomos y hacen que funcionen como una unidad.
Enlace iónico
Se forma al unir un metal con un no metal, donde el metal transfiere sus electrones al no metal. Se forman compuestos con las siguientes características:
- Sólidos cristalinos.
- Solubles en agua, al solubilizarse conducen la electricidad.
- Si son insolubles pero fusionables, conducen la electricidad.
- Insolubles en solventes orgánicos.
- Los puntos de fusión son elevados.
- Son inflamables
Ejemplo: Sales (NaCl, BaSO4). Óxidos metálicos, carbonatos y bicarbonatos.
Enlace covalente.
Se realiza entre no metales, compartiendo electrones. Los compuestos covalentes tienen las siguientes características:
- Son insolubles en agua; si llegasen a solubilizarse en agua, la solución no conducirá electricidad.
- Casi todos son combustibles.
- Puntos de fusión bajos.
- Incluye prácticamente todos los compuestos orgánicos.
Ejemplo: agua, alcoholes, azúcares, grasas y aceites, perfumes, la mayor parte de las drogas y colorantes.
Enlace covalente polar (Heteropolar).
Es realizado entre elementos no metálicos diferentes, en el cual los electrones se comparten de manera desigual entre átomos con distintas electronegatividades. Son solubles en agua y conducen la electricidad.
Ejemplo: Agua, ácido clorhídrico, etc.
Enlace covalente no polar (Homopolar). Se realiza entre elementos no metálicos idénticos compartiendo electrones.. Sus compuestos no son solubles en agua, y no forman estructuras cristalinas.
Ejemplo: Aceite, Cl2, etc.
Enlace covalente coordinado. Es la unión entre dos átomos mediante un par de electrones, credidos por uno solo de los átomos y compartido por los dos.
Ejemplos: SO2, HNO3, etc.
Se puede obtener el tipo de enlace de los compuestos a través de la escala de Pauli:
Tipo de enlace = Electronegatividad del elemento – Electronegatividad del elemento
Más electronegativo menos electronegativo
Por tanto,
- Si la diferencia es mayor de 1.7 es un enlace iónico
- Una diferencia menor de 1.7 es un enlace covalente polar.
- Si no hay diferencia es un enlace covalente no polar.